公司新闻
-
药品研发如何确定杂质限度
-
在药品研发中,如何证实药品安全有效应该是研发人员始终关注的问题;而药品质量的稳定可控又是保证其安全有效的前提与基础。如果一个药品的质量不能达到稳定与可控,在使用时这一药品就不可能始终安全、有效,也就不能被批准上市。保证药品质量稳定可控,药品的纯度是一个重点。如何确定杂质的限度是药学研究人员与审评人员不…

-
干货:详解原料药的工艺验证
-
大家早上好,今天在这里由我与大家一起分享原料药的工艺验证相关内容,本次分享涉及内容为非无菌原料药,无菌原料药不涉及。分享过程中有任何不合理的地方请大家指出。原料药工艺验证一、相关法规及术语相关法规:药品生产质量管理规范(2010年修订)原料药附录ICH Q7A:原料药GMP指南相关术语:非无菌原料药:法定药品标准中…

-
2020版药典,注射剂通则草案公示…
-
各相关单位:按照《中国药典》2020年版编制工作进度安排,四部通则修订草案征求意见稿已于2018年2月起分批次在我委网站面向社会各界公开征求意见。根据征求意见稿的反馈意见和建议,我委组织召开相关专业委员会进行研讨,并整理形成了第二、第三次征求意见稿(第十七批)。第二次公示修改的内容以浅橘色底纹标记,第三次公示修…

-
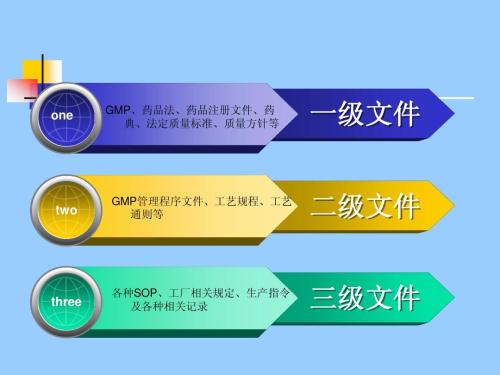
干货:GMP三级文件体系详解
-
1、一级文件:理念性、原则性、纲领性、指导性文件,比如质量方针、验证主计划、工程项目管理规程、厂房设施管理规程、设备管理规程、维护与预防性维护管理规程、计量校准管理规程、变更控制管理规程、偏差管理规程……一级文件就是把法律、法规、规范、指南……的要求,变成公司的指导方针与纲领性文件。2、二级文件:流程性…
-
实验室做风险评估的18个要点
-
实验室做风险评估的18个要点对实验室安全进行风险评估,及时发现安全隐患,采取有效控制措施,尽量避免发生实验室安全事故。实验室应进行风险评估,需要按照下列内容进行评估:1)化学、物理、生物等风险源已知或未知的特性,与环境的交互作用、相关实验数据、过往资料、预防和治疗方案等;2)与实验室本身或相关实验室已发生…

-
《药用配料罐》新标准(草案)发…
-
近日,中国制药装备行业协会发布《药用配料罐》行业标准征求意见的函,该函表示:自《药品生产质量管理规范(2010年修订)》正式实施,GMP法规对设备的要求虽然是有简单的几个字:易操作,易清洗。但却提出了非常高的要求,鉴于现在配料系统的市场越来越大,配料工艺的越来越多样化,无菌理念的日益深化,但药用配料罐标准自…



