公司新闻
-
WHO新发布指南:试验用药品GMP,…
-
11 月 5 日,世界卫生组织(WHO)发布了“试验用药品GMP” 指南(Good manufacturing practices for investigational products)的征求意见稿。该文件是对WHO GMP附录7的修订,目前正处于收集意见期,截止日期为2021年1月。此后,将于2021年2-3月份提交专家工作组,进行讨论,完善后进行第2轮意见收集。最终修订稿计划于2021…

-
生产偏差处理的七个阶段
-
01对事件的报告1.事件观察者发现了任何有可能引发偏差的事件后,应撰写偏差事件报告;或立即向主管报告,由主管或相关人员随后撰写生产偏差事件报告。2.发起者应进行初步调查并立即采取纠正措施。(1)立即采取以下措施(但不仅限于此),以减少事件对生产物料/设备/区域/工艺/程序等的负面影响:停止生产:GMP相关活动的恢复…

-
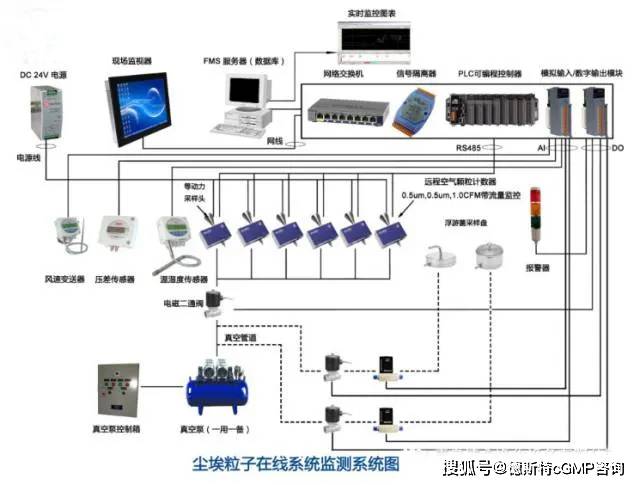
聚焦|GMP在线监测系统—AB级洁净…
-
1、实施动态监测的意义和作用在A/B 级洁净区中,实施动态监测是为人员行为评价、最终产品放行提供必要的依据,以便及时发现其中存在的问题,并及时采取有效的措施解决问题,以防不良影响进一步扩大,同时,也为空气平衡、人员行为和房间消毒方法的进一步改进提供了依据。2、动态监控项目和标准2.1 监测的项目在生产操作前,要…
-
DST德斯特团队为江苏科本药业开展…
-
8月底DST德斯特3位专家前往江苏科本药业,开展计算机化系统验证项目,DST德斯特专家为科本药业的各个部门负责人及工作人员等对计算机化系统验证的定义、法规历程、法规要求及验证前期以及CSV验证的执行等工作做了详细的介绍和培训,同时经过DST德斯特的3位专家进行系统、全面的实施计算机化系统验证后,将验证成果集合成册,…

-
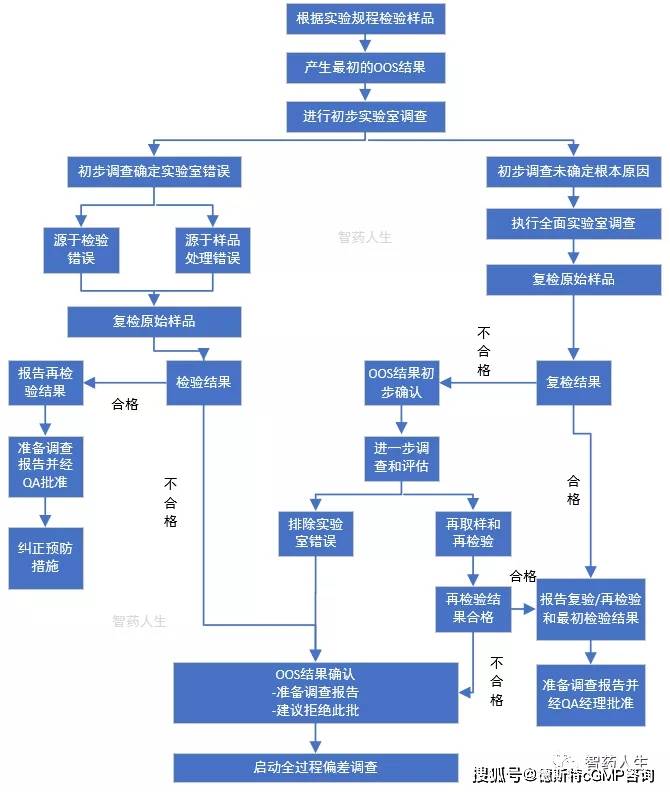
【收藏】实验室OOS调查流程
-
超标结果(OOS)调查是偏差调查的一种类型。质量控制实验室应建立超标调查的书面程序。任何超标结果都必须按照书面规程进行完整的调查,并有相应的记录。(一)实验室初步调查当出现OOS检验结果时应进行调查,调查的目的是确定引起OOS的原因。即使因OOS结果判定该批不合格,仍必须进行调查以确定该结果是否影响到同类产品其他…
-
药企爆发“创新潮”,大批新药获…
-
近年来,我国高度重视医药创新。自 2015 年以来,创新药物的政策就被频繁发布,如《国家创新驱动发展战略纲要》、《" 十三五 " 国家科技创新规划》、《医药工业发展规划指南》等规划指南均提出有关创新药发展的目标,并且还设立了专项以推动新药研发。而在此背景下,药企创新活力不断释放,越来越多的创新药品得以…


