德斯特DST法规组,注意到2024年07月01日国家药品监督管理局药品审评中心(以下简称CDE),发布以网络传输方式提交药品注册电子申报资料的试行通知,自2024年7月1日起,启动药品注册电子申报资料网络传输试行工作,申请人可通过网络传输方式提交药品注册电子申报资料。另有附件:电子申报资料网络传输预约及操作步骤说明,方便指导大家进行电子申报资料提交的操作。
近年来,NMPA自2017年加入ICH后,一直在大力推进药品申报电子平台的建设。为提升“互联网+药品监管”应用服务水平,CDE建立了电子申报资料网络传输通道,在使用光盘提交电子申报资料的基础上,增加网络传输方式,为申请人提交电子申报资料提供多种选择,以提升申请人电子申报资料提交效率。以下为公告的相关内容:
ICH指导原则是关于药品研发的技术指南,包括四类,分别是质量(Quality,Q)、安全性(Safety,S)、有效性(Efficacy,E)和多学科(Multidisciplinary,M)。为统一药品申报资料格式及内容要求,ICH在整体技术指南体系框架下的多学科分类中设置了M4(CTD)和M8(eCTD)议题。

CTD是国际公认的药品申报资料编写格式,共分为五个模块:模块一行政管理文件和药品信息;模块二通用技术文档总结;模块三质量;模块四非临床试验报告;模块五临床研究报告。其中,模块一为区域性要求,具体内容和格式由相应的监管机构规定,模块二、三、四和五为国际通用要求。
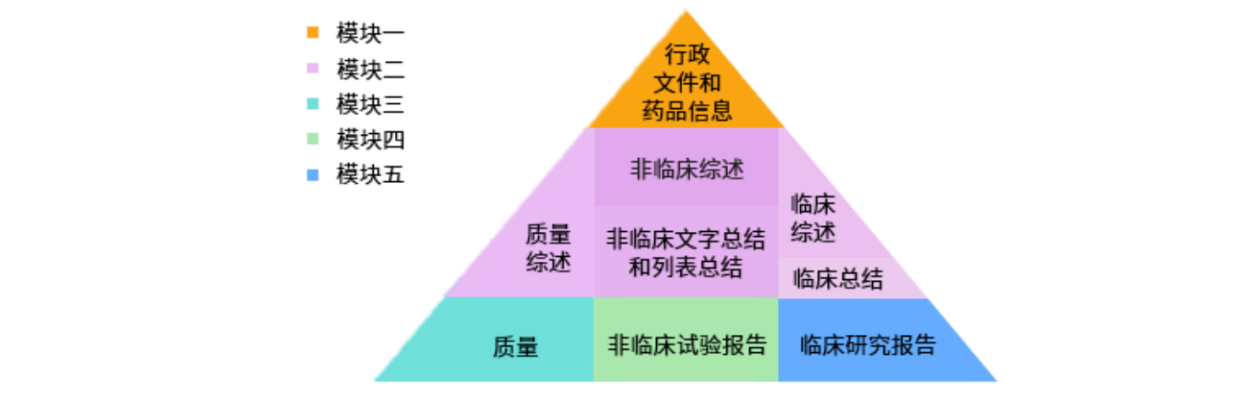
电子通用技术文档(eCTD)是对通用技术文档(CTD)的一种电子化呈现和管理方式,通过可扩展标记语言(XML)技术将基于CTD文件结构和eCTD技术规范的文件加以组织,并用于药品注册申报和审评的一种注册文件技术格式。eCTD使申报资料编制、申报、受理、审评、全生命周期管理和档案存储更加便捷经济,既保障了资料的申报质量,又提高了审评效率,更重要的是使申报资料的格式、内容及标准要求保持全球通用性和一致性。
ICH于2008年发布了《eCTD技术规范V3.2.2》,eCTD 技术规范在多个国家和地区广泛应用。自2017年05月30日起,CDE关于征求《药品电子通用技术文档结构(征求意见稿)》和《化学仿制药电子通用技术文档申报指导原则(征求意见稿)》意见的通知,NMPA和CDE已经发布十份相关的通知,其中NMPA在2021年9月30日发布的关于实施药品电子通用技术文档申报的公告(2021年第119号),明确指出自2021年12月29日起,化学药品注册分类1类、5.1类,以及治疗用生物制品1类和预防用生物制品1类的上市许可申请,可按照eCTD进行申报;在2023年1月29日,CDE关于公开征求《eCTD实施指南V1.1(征求意见稿)》及《eCTD验证标准V1.1(征求意见稿)》意见的通知中,将单个PDF文件应控制在500MB以内修改为200MB以内。
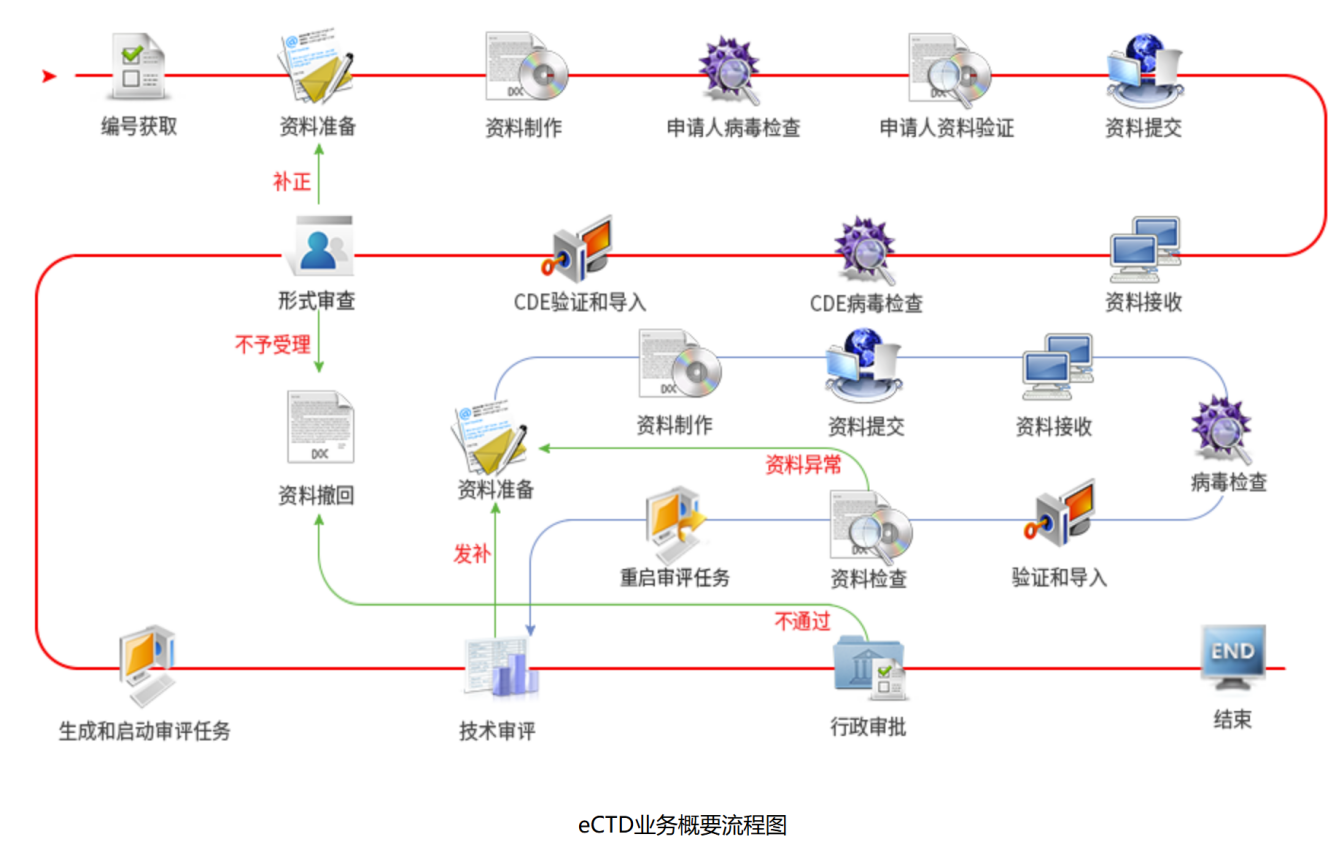
以下是eCTD业务概要流程说明:




 德斯特GMP咨询
德斯特GMP咨询 13427069959
13427069959
