国家药典委员会再次发出的公示稿引入了ICH风险管理理念,“附件 9202 非无菌产品微生物限度检查指导原则公示稿”为企业如何制定合适的非无菌产品微生物限度检查标准提供了实用性的参考价值,德斯特Amy给大家分享具体的内容。

(1)对照培养基的选择——无论是中美欧日本等药典中,均对培养性能(适用性)进行具体描述。中国选用的对照培养基一般由中国食品药品检定研究院研制及分发,但是也往往会发现无法采购部分品种的对照培养基,那么企业需要自行选择对照培养基,如需自行选择对照培养基,应进行充分的风险评估,确保其符合检查方法的要求及检验结果的一致性。
(2)非无菌产药品微生物限度标准需要考虑控制菌——非无菌产药品微生物限度标准中,药用原料、辅料及中药提取物仅规定检查需氧菌总数、霉菌和酵母菌总数,因此,在制定其微生物限度标准时,应根据原辅料的微生物污染特性、用途、相应制剂的生产工艺及特性等因素,还需控制具有潜在危害的致病菌不可接受的微生物。
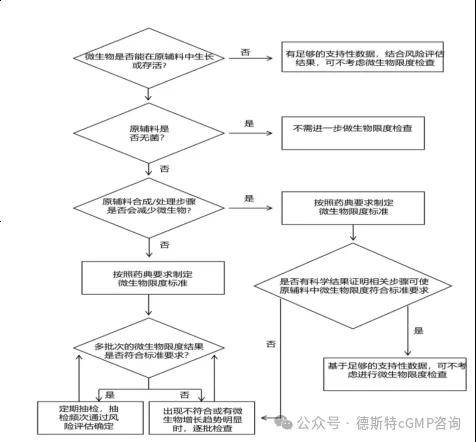
(3)检测频率及标准要求——非无菌化学原辅料微生物限度的控制应基于风险评估,风险评估方法可以参考 ICH Q9《质量风险管理》推荐的风险评估和管理工具。风险评估需综合考虑非无菌化学原辅料的性质(包括起始物料、溶剂、试剂、催化剂等)、生产工艺、生产环境、设备清洁状态、人员素质、最差生产条件、历史数据及趋势等因素。在风险评估的基础上,做出微生物是否能在原辅料中生长或存活、原辅料生产及处理步骤是否会减少微生物的初步判定,从而确定微生物限度检查策略(定期抽检或逐批检查或可不考虑进行检查)及相应的微生物限度标准。
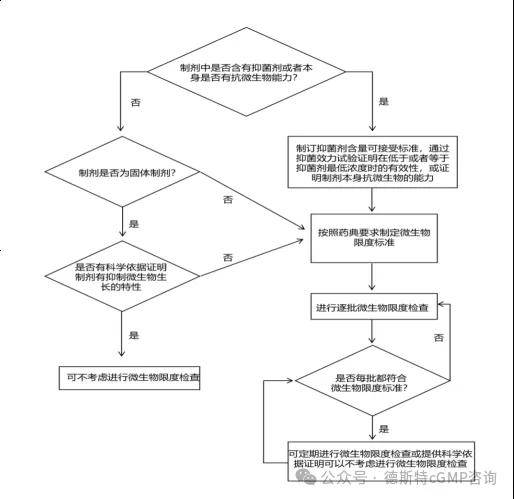
非无菌化学药品制剂及原辅料微生物限度风险评估及控制策略按下述决策树进行评估:
l非无菌化学原辅料微生物限度检查决策树
l非无菌化学药品制剂微生物限度检查决策树
上一篇:物料放行,谁来才合规呢?




 德斯特GMP咨询
德斯特GMP咨询 13427069959
13427069959
