注射剂中的可见异物直接关系到患者用药安全,是注射剂一项重要的质量指标,注射剂中存在的可见异物进入体内可引起血管栓塞、静脉炎、肉芽肿和变态反应等,甚至全身感染,直接危害患者用药安全。近年来可见异物检查不合格以及由此引起的注射剂召回事件频发。因此,注射剂中可见异物的风险评估、生产过程控制和产品检验应引起高度重视。
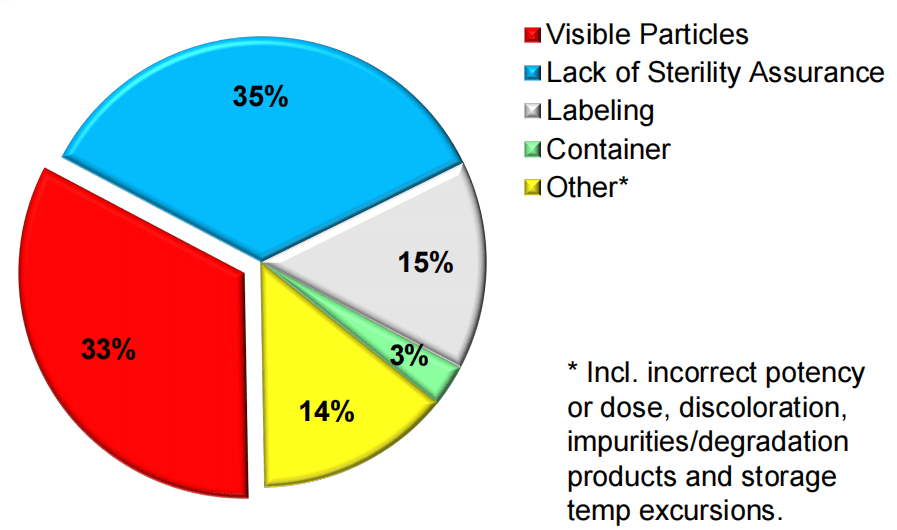
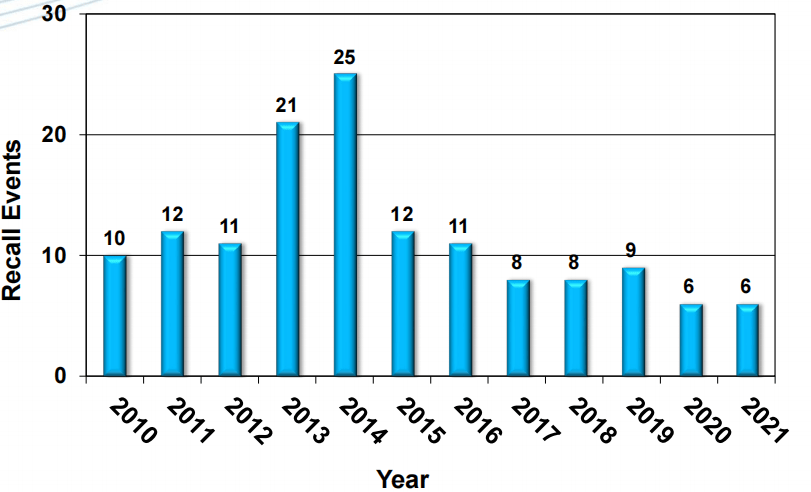
先看FDA公布的2017-2021年间无菌注射剂召回事件分析,涉及可见异物的召回事件占比高达33%!从数据可见,不仅仅是FDA关注度高,产品自身质量控制也确实存在改善空间。
可见异物控制开始于产品开发阶段,应持续贯穿整个产品生命周期,包括贮存期间稳定性评价与上市后产品监控。具体研究内容涉及原辅包选择和质量控制、设施设备选择、产品开发、产品生产过程控制(如中间过程取样控制、100% 检查等)、产品放行检验、贮存期间及临床使用中可见异物考察等,是一个不断持续的质量确认和改进过程。
那么,基于产品生命周期方法的可见异物控制,应从哪些维度做好管控?
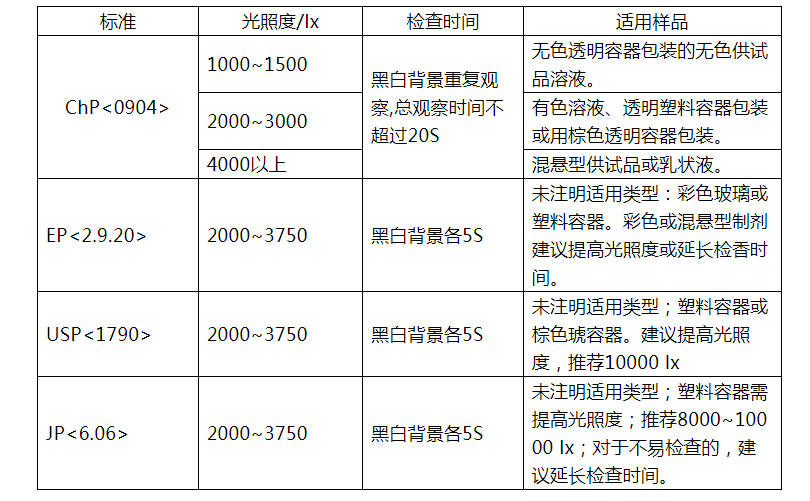
1、各国药典注射剂中可见异物灯检法比较:
2、必须建立一个最大允许的接受限。
3、必须控制产品的复验,包括在适当时,检查条件和允许的复验次数。
4、检查人员必须接受培训,并有培训记录,且必须进行定期的培训。
5、培训和资格鉴定条件必须符合常规的100%检查条件。
6、考虑检查人员的疲劳问题。
7、AQL检查必须采用统计上可靠的抽样计划。
……
写在最后的重点:
1、检查是概率性的;不能仅依靠检查消除所有的缺陷。
2、因此,通过持续的过程改进进行缺陷预防应该成为控制策略的一部分。
3、虽然可见异物通常与目视检查有关,但容器和密闭缺陷也必须被检测和清除。
4、检查人员的培训和资格鉴定是成功的人工目视检查的关键。
对于可见异物检查,你还有哪些痛点?欢迎留言讨论。




 德斯特GMP咨询
德斯特GMP咨询 13427069959
13427069959
