公司业务
一、QP符合性声明(QP Declaration)
QP符合性声明是欧盟及PIC/S 成员国在产品临床阶段的一种正式的GMP符合性声明,具有法律认可的效应,在临床阶段的检查等同于官方的检查。QP需要对企业的GMP执行结果负相应的责任。在临床阶段QP符合性声明可以作为临床阶段的GMP符合性资料递交欧盟或PIC/S国家作为GMP符合性的依据。QP符合性申明也是企业在海外未获得官方GMP证书前,非常好的合规性证明。
根据欧盟QP法规要求,除非特殊情况外,QP符合性声明需要远程检查,企业或当地政府提供证明,QP应到现场进行审核。
PIC/S成员国或地区,涉及到(目前仍在不断增加中):
阿根廷、澳大利亚、奥地利、比利时、加拿大、中国台北、克罗地亚、塞浦路斯、捷克斯洛伐克、丹麦、爱沙尼亚、芬兰、法国(2个)、德国(2个)、希腊、香港、匈牙利、冰岛、印度尼西亚、爱尔兰、以色列、意大利、日本、韩国、拉托维亚、列支敦士登、立陶宛、马来西亚、马其他、荷兰、新西兰、挪威、波兰、葡萄牙、罗马利亚、新加坡、斯洛伐克、斯洛文尼亚、南非、西班牙、瑞典、瑞士、乌克兰、英国(2个)、美国等。
二、QP符合性声明的分类(Classification of the QP Declaration)
1、分为API的符合性声明和FDF的符合性声明:
(1)具有API资质的QP可以签发API的GMP符合性声明;
(2)具有制剂资质的QP可以签发制剂的GMP符合性声明。
三、DST的QP符合性申明优势(QP Declaration of DST stated advantage)
-
DST多位QP专家同时具备API和制剂的QP资质。如果企业涉及到原液和制剂的情况下,可以帮助企业同时完成原液及制剂的检查,并签发API和制剂的QP声明证书;
-
QP具备疫苗、生物制品、化学药、原料药的企业的检查和辅导经验,在检查中帮助企业解决一些实际的GMP相关疑难问题,以便后期正式国际认证顺利通过;
-
DST的QP在中国比较丰富的工作经验,理解中国的很多企业文化及检查方式、在执行过程中可以更好理解企业的一些工作方式;
-
DST在执行QP符合性检查的时候,会同步安排专家到现场指导检查、以便检查顺利进行,同时,帮助企业顺利通过检查;
-
DST专家会帮助企业进行QP符合性检查的缺陷整改,帮助企业提供GMP水平及顺利获得QP符合性声明。
四、DST的QP符合性声明案例(QP statement of DST)
涉及企业,包括不限于:辽宁依生生物、北京昭衍生物、药明生物、瑞科生物、杭州澳亚生物、深圳康泰生物、广东莱佛士、国药中生生物、北京康乐卫生、苏州谱新生物、上海博瑞策生物、浙江恒驭生物、江苏智享生物、广州安济盛生物等。
德斯特具备丰富的帮助企业顺利通过QP符合性声明的实战经验,可以迅速帮助企业顺利通过检查,德斯特有远程及现场QP符合性声明检查的经验。
QP审计图片 QP审计图片
五、DST的QP审计前期准备(QP audit preliminary preparation for DST)
-
法规依据
QP符合性声明的法规主要依据为EU GMP指南,包括正文及附录。
-
总体流程
3、检查日程

-
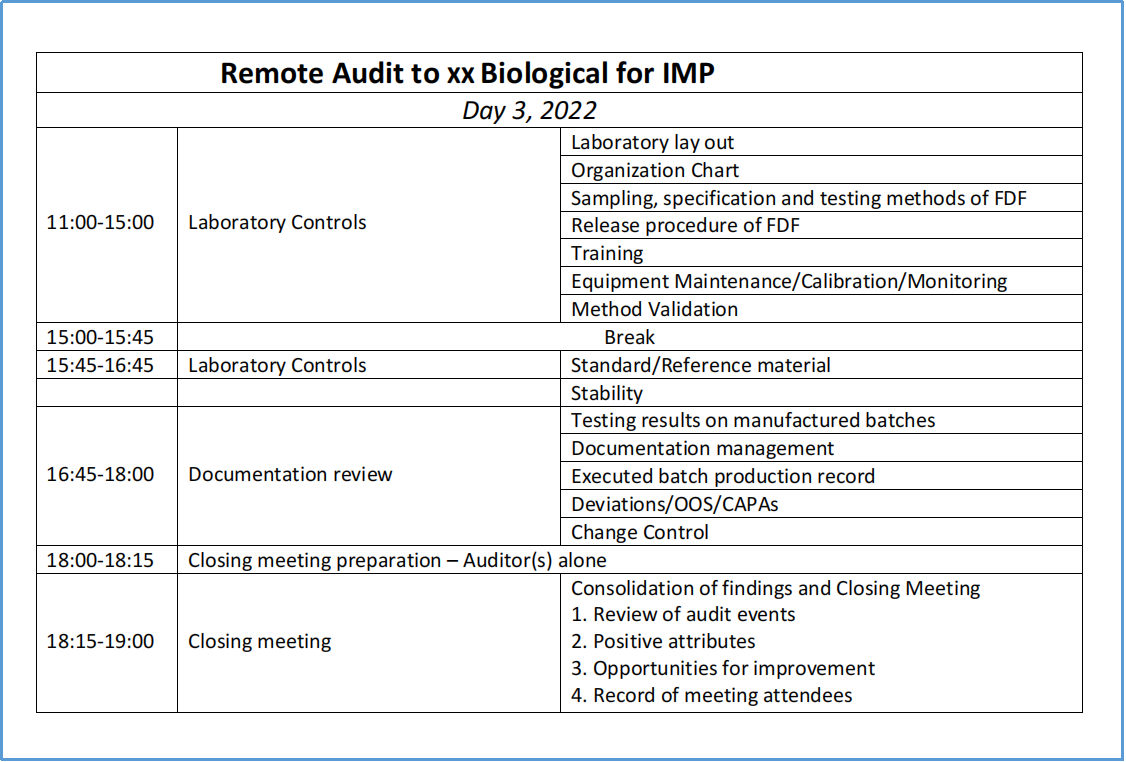
-
六、DST的QP符合性声明流程和事项(The QP Declaration Statement process and matters for the DST)
上一篇:已经是第一篇了
下一篇:已经是最后一篇了




 德斯特GMP咨询
德斯特GMP咨询 13427069959
13427069959
